Last Updated on 15 Dicembre 2024 by Dr. Marco Ternelli
L’argomento di oggi farà discutere, ma fornirà diversi spunti.
Parliamo di fare sterili in farmacia: colliri e/o iniettabili. Cosa serve al Farmacista galenista per poter allestire colliri e/o sterili, qual è la normativa che regola la presenza di una “zona sterili” in una Farmacia con Laboratorio Galenico, quali sono i requisiti strutturali, come organizzarsi?
State per leggere cose che non capirete inizialmente, è normale. Procedete nella lettura e se avete dubbi o domande, postate nei commenti.
Potreste trovarvi, come prima reazione, a rifiutare ciò che è scritto in questo articolo. Per questo l’articolo sarà tecnico e dettagliato per spiegarvi al meglio e farvi capire che “le cose sono effettivamente così”.
Basta con questo alone di mistero e cominciamo.
Colliri e iniettabili: quali differenze nella normativa italiana
La prima cosa da chiarire è qual è la base normativa che regola la produzione dei farmaci sterili (colliri o iniettabili) in una Farmacia Galenica italiana. Ci sono 2 testi:
- le Norme di Buona Preparazione (che molti chiamano “le integrali”)
- le Norme di Buona Fabbricazione (note come GMP o Good Manufacturing Practice)
Già qui potrebbe esserci qualche ciglio aggrottato nel leggere la parola GMP e pensare ad un laboratorio galenico. Ma così è e nel corso dell’articolo verrà ben spiegato con tutti i riferimenti normativi. Come anticipo, considerate comunque che il 90% della normativa per fare sterili in farmacia risiede nelle NBP. Ma quel 10% di GMP (vedrete) è fondamentale e non eludibile.
Bene, chiarito questo partiamo con le cose semplici, cioè chiarire cosa serve al Farmacista Galenista che decide di fare colliri e cosa serve al Farmacista Galenista che decide di fare farmaci iniettabili, ossia quali sono i requisiti strutturali (ambienti, locali, ecc…) e tecnici (procedure, controlli, …).
Quali sono i requisiti strutturali per fare sterili in Farmacia: i colliri
Gli stessi identici degli iniettabili.
Quali sono i requisiti strutturali per fare sterili in Farmacia: gli iniettabili
Gli stessi identici dei colliri
Non è chiaro: quali sono le differenze tecniche e strutturali tra chi vuole fare colliri o iniettabili in Farmacia?
Immaginando un po’ di confusione e stordimento nella testa del lettore fin qui, diamo risposta chiara, precisa e concisa alla domanda sopra:
NESSUNA
[OK…]
Si, avete letto bene. Non c’è NESSUNA DIFFERENZA strutturale e legislativa per un Farmacista Galenista che voglia fare colliri sterili o iniettabili sterili. Nessuna significa… nessuna.
FERMI TUTTI: stiamo forse dicendo che se voglio fare colliri galenici devo avere una camera bianca o comunque un isolatore?
Sì.
Si.
Si.
Detto in altra maniera:
Se nel laboratorio galenico non si ha la camera bianca o stanza almeno ISO 8 con isolatore NON SI POSSONO FARE STERILI: COLLIRI O INIETTABILI.
NBP XII ed.. Dal 2002

Impossibile! Sono anni che ho SOLO la cappa per colliri e non ho mai avuto problemi!
Tutto va bene finché va bene.
Proverbio di anonimo autore nel 2024 🙂
È normale il rifiuto di quanto sopra, cercando risposte dalla prassi quotidiana:
- “Ma nessuno mi ha mai contestato nulla”
- “Faccio così da sempre e non ho mai avuto problemi” (questa è un evergreen :P)
- “Ma la norma prima non era così! È cambiata recentemente?”
- “Figuriamoci se serve la camera bianca per fare 2 colliri ogni tanto”
- “Al corso di galenica di XYZ mi hanno detto che bastava la cappa”
- “L’azienda ABC mi ha detto che con la cappa posso fare i colliri o iniettabili non endovena”
- “mio cuggino mi ha certificato gli ambienti che ho fatto fare a un amico”
Lo spirito di queste risposte è alla base di quanto successe nel 2013 in America, il cosiddetto “scandalo NCCD“: anche in America i galenici sterili venivano fatti da alcune farmacie in maniera non adeguata (es. senza camera bianca, senza tutte le procedure necessarie, senza seguire i requisiti strutturali e procedurali) in seguito del quale vi furono 64 morti (!) e centinaia di malati (es. meningite).
Come conseguenza a questa scandalo, la FDA Americana modificò le normative sullo sterile in maniera molto più stringente, di fatto ridimensionando e ridisegnato il modo di fare sterile: escludendo la maggior parte delle farmacie.
In Italia? Se succedesse in Italia, guardando a cosa è capitato in casi simili in passato (es. sospette morti per preparazioni galeniche anoressizzanti) si potrebbe ipotizzare, probabilmente, la chiusura dell’attività sterile nelle farmacie galeniche italiane o, in alternativa, l’istituzione di farmacie centralizzate controllate pesantemente da AIFA. Davvero vogliamo questo?
La paura dell’Autore è che sia solo questione di QUANDO (e non di SE) succederà un evento disastroso in Italia nella galenica sterile. Quanto scritto in questo articolo ha anche lo scopo di sensibilizzare il più possibile, promuovere conoscenza (e coscienza), proteggere i pazienti.
Non ci credo! Sono anni che ho SOLO la cappa colliri e nessuno mi ha mai contestato nulla!
Stiamo parlando di avere uno scenario in cui un farmacista ha installato una cappa colliri in un qualsiasi ambiente del laboratorio o comunque senza le indicazioni delle GMP. Qui tocchiamo un tasto parecchio dolente. Come già scritto, la norma sugli sterili è del 2002 (oltre 20 anni prima della pubblicazione di questo articolo).
Com’è possibile che in tutto questo tempo non si sia sviluppato una corretta impostazione normativa del laboratorio, ma che ci siano numerose farmacie che eseguono colliri in queste condizioni?
Alcune possibili risposte (alcune politicamente scorrette forse, ma la verità va detta):
- fino a qualche anno fa, lo sterile non se lo filava nessuno 😉
- oltre l’85% (fonte) delle farmacie segue le “NBP semplificate” (DM 2003) e probabilmente non ha mai veramente letto le NBP integrali, dato che il DM 2003 non tratta (e non permette, v. già avanti) la preparazione di galenici sterili
- chi si occupa di verifiche e ispezioni non ha comunque quell’attenzione / approfondimento nel valutare la normativa, tenendo conto che lo sterile oltre alle NBP richiede anche una minima conoscenza delle GMP
- chi vende “cappe per colliri” (certificate?) a un farmacista non è tenuto a sapere cosa quel farmacista ne farà, come la userà, dove la installerà. Il venditore è a posto. La responsabilità finale è del Farmacista Galenista.
Da dove nasce l’idea che in farmacia si possano fare colliri senza ambienti previsti dalle NBP?
Con questa domanda ci riferisce al luogo comune per cui “per fare i colliri basta una cappa per colliri”, senza ambienti dedicati A-B-C-D.
Probabilmente, l’equivoco nasce dall’idea che essendo consentito dal Dlgs 16/2010 e succ. mod. in ambienti oculistici avere un ambiente D con all’interno una cappa per colliri, si sia “traslato” questa possibilità anche alla farmacia.
Ora, posto che tale dettame nulla ha a che vedere con le farmacie, per i laboratori galenici esiste una specifica normativa (NBP) che descrive esattamente e precisamente quali sono i requisiti per eseguire preparazioni sterili (senza distinguere tra colliri o iniettabili o altro) in un laboratorio galenico.
Dulcis in fundo, la norma dei colliri citata all’inizio prevede comunque che la cappa per i colliri sia una clean room zona D (almeno ISO 8), e non che sia genericamente posizionate in un punto del laboratorio o in una stanza normale, seppur dedicata, senza classificazione ISO.
Le cappe a flusso laminare per sterili (colliri o iniettabili) NON sono le cappe di sicurezza o cappe biologiche!
Sì, c’è bisogno di chiarirlo.
Le NBP per gli sterili in Farmacia, spiegate bene
Adesso entriamo nello specifico. Facciamo nomi delle leggi, riferimenti ai punti, ecc…
Come già detto, la norma che regola la preparazione di farmaci sterili in farmacia nel Laboratorio Galenico sono le Norme di Buona Preparazione, in particolare i paragrafi da pagina 1417 a 1426.
In queste (poche) pagine le NBP descrivono le cose necessarie da fare per garantire la sterilità e quindi la sicurezza del farmaco e, di conseguenza, la sicurezza del paziente. Queste descrizioni dicono COSA serve, ma non COME farlo. Questo punto è importantissimo.
Ma allora possiamo interpretare? Può essere che una cappa colliri sia sufficiente per fare sterili in farmacia?
Ci sono 2 (DUE) specifiche e precise eccezioni a quanto appena affermato sopra: sono 2 punti in cui le NBP sostanzialmente dicono COME fare una determinata cosa non spiegandolo direttamente, ma indicando come riferimento le GMP.
In altre parole, quando nel 2002 usci la Farmacopea Italiana XII edizione, le NBP davano indicazioni di seguire alcune parti del GMP del 2002. Nel 2024 le NBP della Farmacopea Italiana XII edizione non sono cambiate (sic!), ma sono cambiate le GMP e l’Annex I (Agosto 2023 è l’ultimo aggiornamento disponibile alla data del presente articolo). Quindi:
- NBP sempre quelle dal 2002
- GMP cambiano nel corso degli anni
Venendo al dunque, sono 2 i punti in cui le NBP “rinunciano” a dare riferimenti e indicano invece di fare riferimento diretto alle GMP, nello specifico l’Annex I (o Allegato I):
- quando si parla di locali in cui fare preparazioni sterili
- quando si parla di limiti microbiologici
Ambienti in cui fare sterili in Farmacia: NBP e GMP
Gli ambienti di preparazione devono essere separati dagli altri locali di preparazione. Gli ambienti dovranno essere classificati secondo il grado di rischio del processo impiegato in conformità all’Allegato 1, Fabbricazione di medicinali sterili, delle Norme di Buona Fabbricazione [GMP, ndr]
Paragrafo 11.1.2 FUI XII ed. – pag. 1423
Cos’è l’Allegato 1? Nel settore è meglio noto come Annex I (leggasi “Annex primo”) ossia un allegato tecnico in cui sono contenute tantissime informazioni dirette o indirette su sterilità, locali, procedure, personale, strumenti, limiti, test, analisi, metodiche.
Di tutta questa roba 😉 quello che interessa in questo paragrafo delle NBP sono i riferimenti ai locali che le GMP classificano in base alle ISO:
- Zona A: semplificando, la cappa a flusso laminare [nota tecnica: deve essere almeno una ISO 4.8]
- Zona B: zona è in cui è presente la cappa a flusso laminare [nota tecnica: deve essere almeno una ISO 7]
- Zona C: zona di vestizione, filtrazione, autoclave, preparazioni ad alto rischio [nota tecnica: deve essere almeno una ISO 7]
- Zona D: zona di lavoro delle preparazioni a basso rischio [nota tecnica: deve essere almeno una ISO 8]
In base all’Annex I (e quindi anche alle NBP) tutte queste zone devono:
- essere in sovrapressione una con l’altra (dall’ISO minore all’ISO maggiore)
- avere sistemi di apertura che impediscano la contemporanea apertura di più porte
- avere sistemi di controllo per regolazione e controllo della pressione
- ecc…
Tutto questo requisito delle NBP/Annex I si può ottenere in un laboratorio galenico solo in 2 modi:
- tramite una camera bianca (con 4 ambienti, ulteriori informazioni)
- tramite un dispositivo detto “isolatore” (ulteriori informazioni) che permette di ottenere 3 ambienti (A-B-C), ma no il 4° motivo per il quale va installato in una clean room (stanza) classificata D (es. ISO 8).
ISO: cosa sono? Camera bianca o isolatore?
Abbiamo parlato finora di ISO, ma non abbiamo spiegato esattamente cosa sono e a cosa si riferiscono nel campo degli ambienti sterili.
La ISO (International Organization for Standardisation) è la più grande istituzione a livello mondiale per lo sviluppo e la pubblicazione di norme internazionali. Con riferimento alla qualità o purezza dell’aria.
La seguente tabella spiega in maniera precisa i valori di particelle ammesse in un determinato ambiente e la relativa classificazione in ISO:
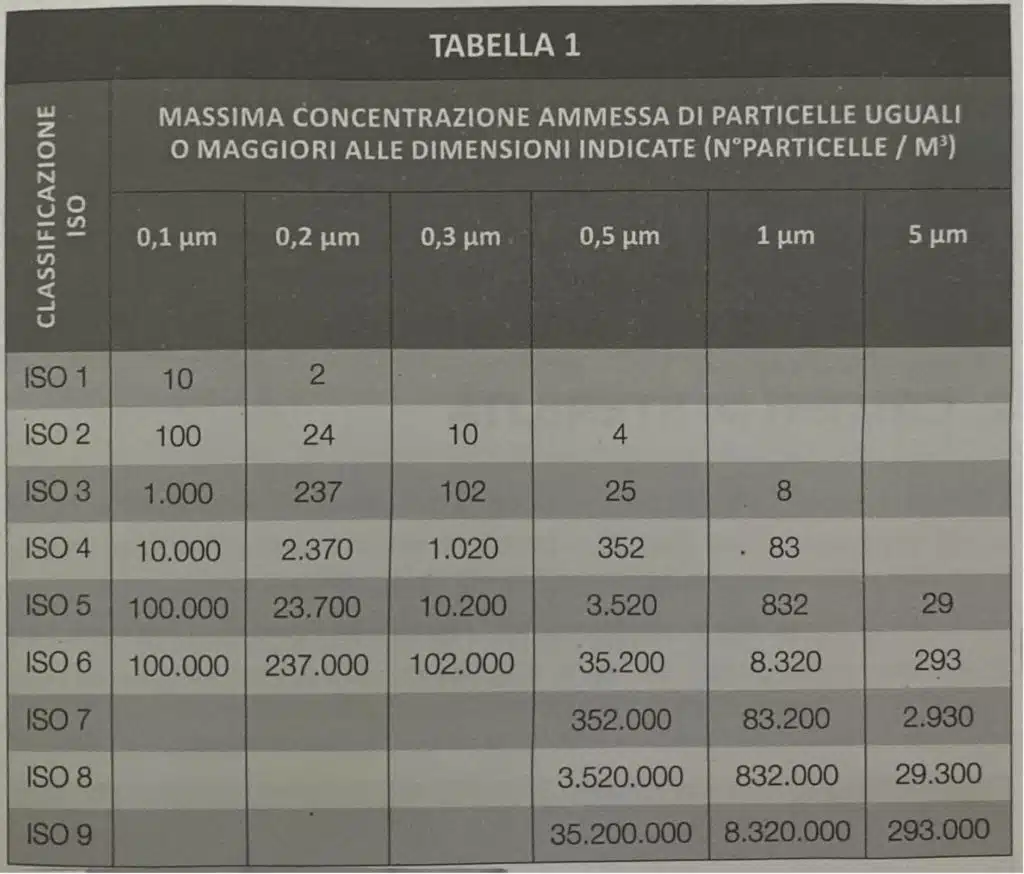
Sembrerà un ripetizione, ma: ribadiamo la differenza dal punto di vista delle zone tra camera bianca (“clean room”) e isolatore:
- la “camera bianca” è un insieme di stanze collegate tra loro classificate con gli ISO in base al tipo di lavorazione da eseguire. Sono MOLTO costose.
- gli isolatori sono macchinari che dispongono delle zone A-B-C. Sono costosi, ma meno di una camera bianca.
Al lettore attento non sarà sfuggito un fatto: un isolatore, per essere a norma, deve essere collocato in una zona D, ossia ISO 8. Ergo, collocare un isolatore in un punto qualunque del laboratorio non permette al Farmacista Galenista di allestire farmacia galenici sterili (colliri o iniettabili), ma è necessario un ambiente isolato e certificato in base all’Annex I.
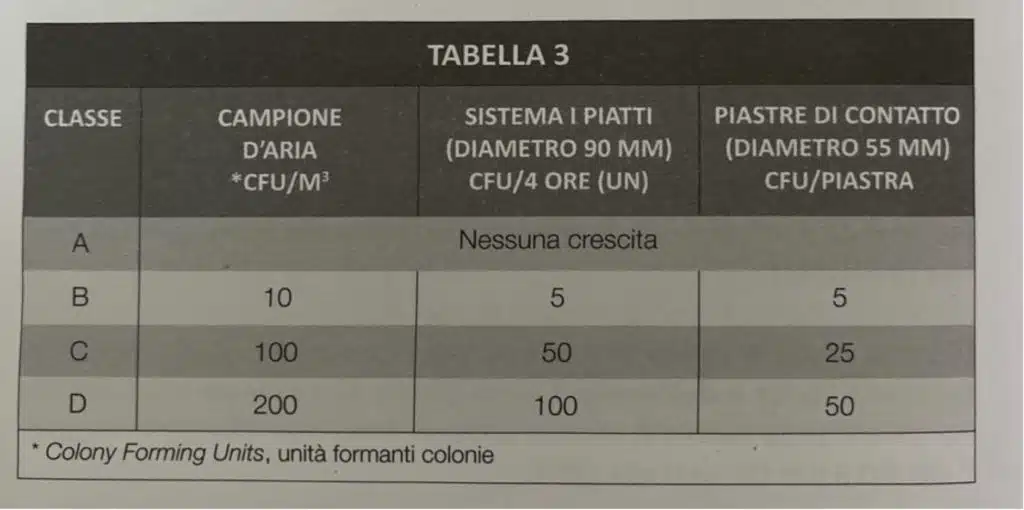
Limiti microbiologici per gli sterili in farmacia: NBP e GMP
I controlli dovranno essere definiti da un apposito piano di campionamento commisurato agli ambienti e al loro utilizzo, che riporti i punti di prelievo, il numero dei saggi, le frequenze dei controlli, le metodiche utilizzate, le azioni previste al superamento dei valori limite. Per i valori limite l’attuale riferimento è costituito dall’Allegato 1, Fabbricazione di medicinali sterili, delle Norme di Buona Fabbricazione [GMP, ndr]
Paragrafo 11.4 – pag. 1424
Anche in questo caso, le NBP indicano che le “istruzioni precise” sui limiti microbiologici sono da “prendere” nell’Annex I. Il Farmacista Galenista ha l’obbligo di eseguire test sul farmaco, l’ambiente e le procedure. E i limiti di accettabilità di questi test sono nelle GMP (Annex I):
Le GMP sono GMP. Le NBP sono NBP.
Attenzione però alle derive: nello sterile nel laboratorio Galenico della Farmacia NON è obbligatorio seguire tutte le GMP per la preparazione degli sterili (colliri o iniettabili): l’obbligo perentorio è SOLO per i 2 punti specifici dell’Annex I descritti in questo articolo richiamati dalle NBP.
Su tutto il resto, il Farmacista deve seguire le NBP che danno indicazioni generali (ma che richiedono sempre di documentare) su come condurre le gestione dello sterile.
Ciò detto, se il Farmacista Galenista volesse indicazioni meno generali di quelle NBP, preferendo indicazioni chiare e precise può scegliere di attingere all’Annex I delle GMP.
Davvero non c’è altra interpretazione delle NBP per poter fare dei semplici colliri sterili in farmacia?
Davvero. Non c’è.
Ma ammettiamo che ci sia. Solo per un attimo, facciamo (molto) finta che quanto avete letto finora non sia vero. C’è un’altra cosa da considerare nelle NBP: le “semplificate”.
Se sei un Farmacista Galenista, prima di proseguire rispondi a questa domanda: nel laboratorio galenico in cui lavori segui le “semplificate” o le “integrali”? Risposto? Ok, ora continua.
Le norme di seguito descritte [NPB “integrali”, ndr] si applicano alle preparazioni, magistrali o officinali, eseguite in farmacia, sia essa aperta al pubblico che ospedaliera.
CAMPO DI APPLICAZIONE delle NBP – pag. 1417
La farmacia che esegue preparati officinali non sterili su scala ridotta e preparati magistrali non sterili può discostarsi in parte da quanto descritto nei paragrafi che seguono, purché sia in grado di mantenere sotto controllo, dimostrandolo [DM 2003, ndr], l’intero processo.
Avete già capito vero? Chi vuol fare sterili di qualsiasi tipo, PRIMA ANCORA DI RAGIONARE DI CAMERA BIANCA o ISOLATORE, DEVE (imperativo) obbligatoriamente seguire le NBP “integrali“.
Non è legalmente consentito fare colliri o iniettabili in laboratorio galenico se si seguono le norme “semplificate” (DM 2003).
Alla data di pubblicazione dell’articolo, risultano censite circa 2.200 farmacie che fanno preparazioni galeniche, di cui oltre l’85% segue le semplificate ergo non può fare sterili.
Riassumendo:
- semplificate con cappa colliri da qualche parte nel laboratorio? Non a norma
- integrali con cappa colliri da qualche parte nel laboratorio? Non a norma
- integrali con cappa colliri in camera bianca o isolatore in zona D? Legale
Concludiamo ricordando che questo articolo non è una guida allo sterile nel Laboratorio Galenico, per cui c’è molto molto altro da conoscere per chi vuole fare galenici sterili, siano essi colliri o iniettabili.
Da dove partire quindi? Ovvio, dalle NBP (integrali) della Farmacopea Italiana. Leggetele (potete scaricarle da qui sotto).
Se invece volete un “riassunto” con slide che spiegano l’Annex I (anche se in versione datata), in particolare le caratteristiche delle zone A-B-C-D, ecco un link molto utile.
Alla prossima!

Farmacista appassionato di Galenica, Legislazione Farmaceutica e Farmaci al banco. Amministratore di Farmagalenica.it, Farmacosmetica.it e Cercagalenico.it.
Nel 2013 si è specializzato in preparazioni galeniche a base di cannabinoidi e cannabis medica e ha conseguito un Master alla Bedrocan BV. Da sempre lavora presso l’omonima Farmacia.
Iscrizione Albo dei Farmacisti


Grazie Marco, un piacere leggerti
Grazie per questo intervento. Aggiungo solo di fare attenzione che per GMP i limiti variano se misurati in operation o at rest, mentre in ISO no (la conversione deve tere conto di questo aspetto).
Secondo punto gli isolatori in D sono solo quelli definiti closed, mentre la quasi totalità degli isolatori installati in farmacia appartiene alla categoria open (per la definizione potete vedere “question and answer” dell’ ema su annex 1). Gli isolatori open richiedono grado C come background e non D secondo new annex 1.
Ciao e buon lavoro!
Finalmente! Speriamo che questo articolo contribuisca a diffondere maggiormente la normativa sugli sterili e venga letto sia da chi li prepara sia da chi deve effettuare le verifiche. Prima che capiti l’evento infausto che si ripercuote su tutti i galenisti. Complimenti e grazie.
🙂
ho letto con piacere l’articolo. Condivido tutto, un piccolo appunto, classe A corrisponde ad una ISO 4.8. Grazie Marco!
Grazie a te per la segnalazione, corretto.